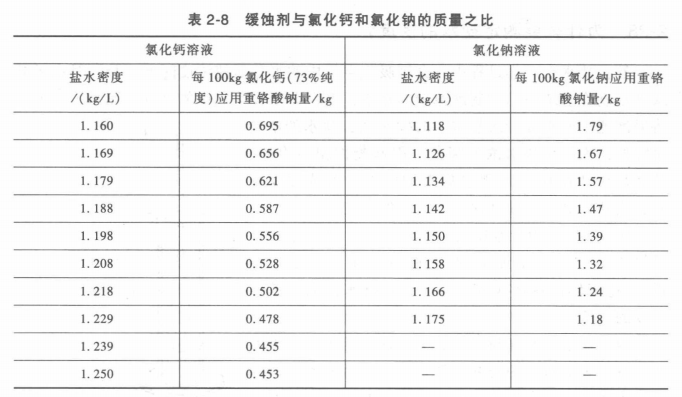
鹽水的性質與溶液中的鹽量多少有關。鹽水的凝固點取決于鹽水的含量,圖2-8中的a和b圖分別表示氯化鈉鹽水和氯化鈣鹽水的凝固點與含量關系。圖線中左邊曲線表示出隨鹽水的含量增加,鹽水的凝固點就降低,一直到冰鹽共晶點為止,此點相當于全部鹽水凍結成一塊冰鹽結晶體,冰鹽共晶點是最低的冰點,如果鹽水的含量不變,而溫度降低.低于該含盆所對應的冰點時,則有冰從鹽水中析出,所以共晶點左面的曲線就是析冰線。由此可見,當鹽水含量一定時,其凝固點的溫度也是一定的,在一定范圍內,含量增加,冰點降低。當含量超過共晶點時,就會有結晶鹽從鹽溶液中析出而冰點升高,所以冰鹽共晶點右面的曲線又稱析鹽線。不同的鹽水溶液共晶點是不同的,如氯化鈉鹽水,質量分數為23.1%時,共晶點溫度為-21.2℃;氯化鈣鹽水,質量分數為29.9%時,其共晶點溫度為-55℃。所以我們在選擇鹽水溶液時,鹽的含量一定要適中。過大和過小都是不利的。一般情況是使鹽水凝固點比系統中制冷劑蒸發溫度低4~8℃。
氯化鈉等鹽水溶液最大的缺點是對金屬有強烈的腐蝕作用。實踐證明,金屬被腐蝕與鹽水溶液中的含氧量有關,含氧量越大,腐蝕性越強。鹽水中的氧主要來自空氣,為了減少含氧量最好采用封閉式鹽水系統,減少與空氣接觸。此外,可向鹽水中加一定量的緩蝕劑,一般采用氫氧化鈉(NaOH)和重鉻酸鈉(Na2Cr2O7),溶液呈堿性反應(pH值≈8.5),可用酚酞試劑測試。注意重鉻酸鈉有毒,能使皮膚破裂,有腐蝕作用,調配溶液時應小心。
鹽水中加緩蝕劑最適宜的添加量為:
1m3氯化鈉鹽水溶液應加入NaOH 0. 87kg, Na2Cr2O7 3. 2kg,1m3氯化鈣鹽水溶液應加入NaOH 0. 32kg, Na2Cr2O7 1.6kg,重鉻酸鈉與氫氧化鈉的質量之比應為100:27,即每100kg重鉻酸鈉需加入27kg氫氧化鈉。
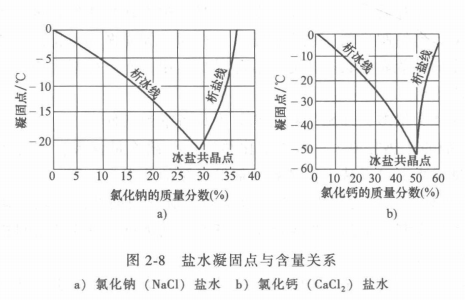
緩蝕劑與氯化鈣和氯化鈉的質量之比見表2-8。